
(926)274-88-54
Бесплатная доставка.
Бесплатная сборка.
График работы:
Ежедневно. С 8-00 до 20-00.
Почта: soft_hous@mail.ru
 |
Звоните! (926)274-88-54 Бесплатная доставка. Бесплатная сборка. |
Ассортимент тканей График работы: Ежедневно. С 8-00 до 20-00. Почта: soft_hous@mail.ru |
|
Читальный зал --> Изменение энтропии + [(du/dv)r + p]idv/dTi, Cp = c,+ [(du/dv), + p\ {dv/dT}p. (2.19) Это уравнение показывает связь между теплоемкостями Ср и Cv Для идеального газа оно значительно упрош,ает-ся. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому {ди/ди)т = 0 и, кроме того, из уравнения состояния (1.3) следует р {dv/dT)p = R, откуда Cp = C, + R- (2.20) Соотношение (2.20) называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов. В процессе у = const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому Ср больше Cv на величину этой работы. Для реальных газов Cp - c >R, поскольку при их расширении (при р = = const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты. Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики. Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергии идеального газа прямо пропорциональна числу степеней свободы молекул и энергии кТ/2, приходящейся на одну степень свободы. Для 1 моля газа 1де No - число Авогадро; i - число степеней свободы (число независимых координат, ко- торые нужно задать для того, чтобы полностью определить положение молекулы в пространстве) . Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатних осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движении она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы (энергия вращения вокруг оси, соединяющей атомы, равна нулю, если атомы считать точками). Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных. Поскольку для идеального газа цс = = dUf/dT =/iipuR, то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно: цс = V2M-/?= 12,5 кДж/(кмоль- К); р.с = = y,iiR = 20,8 кДж/(кмоль К); \ic,--= /2 \iR = = 24,9 кДж/(кмоль-К). Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур (табл. 2.1), однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости. Эта теория устанавливает пре: де всего несправедливость теоремы о равномерном рас- Таблица 2.1. Теплоемкость некоторых газов при / = 0С в идеально-газовом состоянии
пределении энергии по степени свободы в области низких и высоких температур. С уменьшением температуры газа происходит вымораживание числа степеней свободы молекулы. Так, для двухатомной молекулы происходит вымораживание вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры. Теплоемкость реального газа зависит от давления, правда, очень слабо. Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости. Средней теплоемкостью Сер д а н н о г о процесса в интервале температур от / до называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур: поэтому Сср<;=?/(2- Выражение c = bq/dT (2.21 (2.22) определяет теплоемкость при данной температуре или так называемую истинную теплоемкость. Из (2.22) следует, что q=\cdt. (2.23) 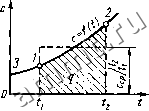 Рис. 2.3. Зависимость истинной теплоемкости от температуры cX=\cdt/(t,-U). Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от О до t. Для уяснения методики определения средней теплоемкости по указанным таблицам воспользуемся рис. 2.3. Заштрихованная площадь эквивалентна количеству теплоты q = 2 = cdl, необходимому для нагревания I кг рабочего тела от tt до С2. Ее можно заменить равновеликим прямоугольником с основанием h - tt и высотой, численно равной средней теплоемкости с,.. -cpiv тогда = с,р<,(2-г,). Аналогично количества теплоты, необходимые для нагрева I кг рабочего тела от О до ii и от О до 2, равны соответственно Qi-с,\о q2 = c\gt,2 и эквивалентны площадям iltfi и ,32/20. Разность этих площадей дает заштрихованную площадь, следовательно, q = q2 - q] = откуда (2.24) Все изложенное относится также к мольным и к объемным теплоемкостям. 2.6. ЭНТАЛЬПИЯ В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н. H=U+pV. (2.25) Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоу-лях 1Дж). Энтальпия обладает свойством адди-h = u+pv, (2.26) тивности. уВеличина называемая удельной энтальпией (h = H/M), представляет собой энтальпию системы, содержащей 1 кг вещества, и измеряется в Дж/кг Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния: Л = г5,(р,у); /г = ф2(и,Г); h = y,(p,T), а величина dh является полным дифференциалом. J Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процессал Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G (рис. 2.4). Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: E=U-\--Gy. В условиях равновесия (G = pF) эту функцию можно выразить через параметры газа: E=U -\-pFy=U -\-pV. Получаем, что Е = Н, т.е. энтальпию можно трактовать как энергию расширенной системы. Уравнение (2.11) 6q = du+pdv в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения pdv = = d{pv) - vdp может быть записано в виде 6q = d {и-\-pv) - vdp, или bq = dh-vdp. (2.27) Из этого соотношения следует, что если давление системы сохраняется не- изменным, т. е. осуществляется изобарный процесс (dp = 0), то 6p = d/i (2.28) (2.29) т. е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы. Это выражение очень часто используется в расчетах, так как огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбин и реактивных двигателей, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, а не внутренней энергии. Для идеального газа с учетом (2.18) и (1.3) получим dh = du + d{pv) = c dT + Rd Т = = {c + R)dT = c.dT. (2.30) Так как между энтальпией и внутренней энергией существует связь (2.26), выбор начала отсчета одной из них не произволен; в точке, принятой за начало отсчета внутренней энергии, h-~pv. Например, для воды при / = 0,01 °С и р = = 610,8 Па, ы = 0, а /х = ру = 610,8Х XO.OOl =0,611 Дж/кг. При расчетах практический интерес представляет изменение энтальпии в конечном процессе: Ah = h-h=\cdT. (2.31) Рис. 2.4. К определению физического смысла энтальпии Контрольные вопросы и задачи 2.1. 1 л воды нагревается с помощью электрического кипятильника мощностью 300 Вт. За какое время вода нагреется до температуры кипения, если теплообмен с окружающей средой отсутствует, а начальная температура воды равна 20 °С? 2.2. Найти среднюю удельную теплоемкость азота в интервале температур 1000-
ООО «Мягкий Дом» - это Отечественный производитель мебели. Наша профильная продукция - это диваны еврокнижка. Каждый диван можем изготовить в соответствии с Вашими пожеланияи (размер, ткань и материал). Осуществляем бесплатную доставку и сборку. Звоните! Ежедневно! (926)274-88-54 Продажа и изготовление мебели. Копирование контента сайта запрещено. Авторские права защищаются адвокатской коллегией г. Москвы. |